Il caleidoscopio dei colori di una fiamma ha un fascino irresistibile. Danzando dal giallo luminoso al rosso intenso, oppure tra sfumature di viola, blu e verde, è un dipinto vivace e policromo che cattura lo sguardo di chi lo contempla. È forse però meno noto che la comprensione di quei colori sia stata una delle vie maestre – forse la più feconda – non solo dello sviluppo della Meccanica Quantistica ma pure delle sue successive riformulazioni e perfezionamenti imposti dalla Relatività Ristretta di Albert Einstein.
Se, certamente, in prospettiva storica e cronologica, le ipotesi avanzate da Max Planck (1900) per spiegare le proprietà termodinamiche del cosiddetto corpo nero (un corpo ideale capace d’assorbire perfettamente ogni forma di radiazione elettromagnetica di qualunque lunghezza d’onda o frequenza) e la teoria di Einstein (1905) sull’effetto fotoelettrico (la corrente di elettroni espulsa da un metallo illuminato sottovuoto) abbiano posto le fondamenta della teoria, fu Niels Bohr ad aprire lo scrigno dei quanti, inventando la prima formulazione della nuova meccanica che oggi chiamiamo “quantistica” e che ebbe come primo e convincente successo la spiegazione del colore degli atomi o, più esattamente, del colore del più semplice degli atomi, l’idrogeno.
Le fiamme appaiono variopinte e cangianti secondo una tavolozza continua, ma è un’illusione, uno scherzo dell’occhio. Se ne accorsero per primi Robert Bunsen e Gustav Kirchhoff, gli inventori della spettroscopia, la tecnica di separare i colori della luce emessa dalla fiamma di un becco Bunsen usando un prisma o, meglio, un reticolo di diffrazione, uno schermo opaco intagliato da fitte fenditure sottili e parallele che, grazie alla diffrazione e all’interferenza della luce, separa le diverse lunghezze d’onda più efficacemente e nitidamente di un prisma. Bruciando una a una sostanze diverse e analizzandone la luce, Bunsen e Kirchhoff scoprono una misteriosa e intrigante proprietà: ogni specie chimica – oggi diremmo ogni atomo o molecola – emette un caratteristico spettro di colori, un insieme di righe singole che appaiono sullo schermo in uscita dal reticolo. Ogni atomo ha un’impronta digitale sua propria, un insieme di righe emesse solo da quell’atomo se sufficientemente riscaldato. Si accorgono pure che le stesse identiche righe sono assorbite dal gas stesso quando la luce lo attraversa, generando il negativo dello spettro di emissione: alla stessa lunghezza d’onda d’ogni riga colorata in emissione corrisponde una nitida banda nera in quello d’assorbimento.
Già Joseph von Fraunhofer, mezzo secolo prima, aveva notato righe scure nello spettro solare, ma dobbiamo a Kirchhoff la riproduzione del fenomeno in laboratorio, la definizione delle prime leggi empiriche e l’avvio della loro comprensione riconoscendo la corrispondenza tra righe e specie chimiche.
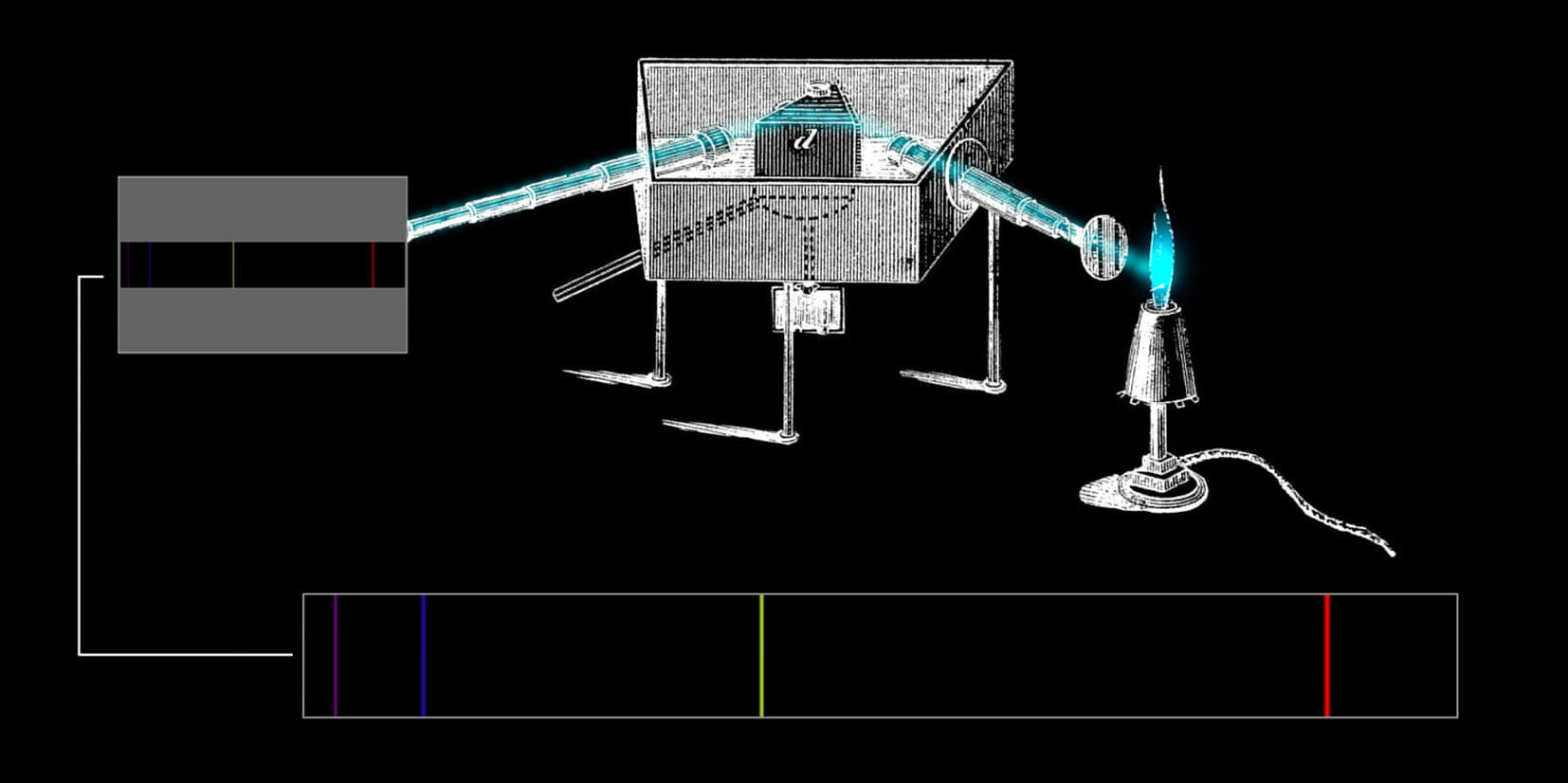
Dal rosso carminio del litio, al giallo intenso del sodio, fino al violetto-rosso del potassio e il verde-azzurro del rame, i colori di fiamma diventano una tecnica di analisi potente del contenuto chimico di un gas. Bunsen e Kirchhoff intuiscono la portata del fenomeno e, pur non comprendendone la natura profonda, iniziano a farne uso. Scoprono attraverso gli spettri elementi nuovi (il cesio e il rubidio, identificati perché di colori mai visti in sostanze note), seguiti da altri scoperti in anni successivi dai colleghi. Offrono anche un mezzo potentissimo di indagine a distanza, anche astronomica. Grazie a loro le righe già osservate da Fraunhofer acquistano un senso come l’effetto dell’assorbimento di elementi specifici nell’atmosfera solare, dando il via a una tecnica che ancora oggi si usa per studiare l’atmosfera di pianeti extra-solari e cercarvi segni di vita. L’elio è così chiamato perché è stato individuato spettroscopicamente nella luce del Sole prima d’esser rintracciato all’interno di rocce radioattive terrestri.
Il numero e la posizione delle righe restarono però un insondabile mistero. Nel 1885 Johann Jakob Balmer, un estroso insegnante di matematica svizzero appassionato di fisica, s’accorge che le quattro righe note della parte visibile dello spettro dell’idrogeno – il più semplice degli elementi, che oggi sappiamo fatto da un singolo elettrone legato a un singolo protone – obbediscono a una formula da lui trovata, poi estesa in anni successivi prima da Rydberg (1889) e poi da Ritz (1908) per includere le porzioni ultraviolette e infrarosse dello spettro e per applicarla ad altri elementi. Formule che per mezzo di una singola costante nota oggi come “costante di Rydberg” riproducono molto accuratamente i dati ma che lasciano interdetti e attoniti: le lunghezze d’onda sono determinate con precisione da due numeri interi, ma nessuno ha la minima idea di che cosa questi numeri significhino, né da quali leggi originino. La formula funziona quasi per magia senza alcun fondamento nella fisica nota.
Quando Rutherford nel 1911 delucida la struttura dell’atomo come un insieme di elettroni legati a grande distanza da un microscopico nucleo atomico (l’atomo è circa centomila volte più grande del nucleo interno, quindi gli atomi sono essenzialmente vuoti) la questione prende i contorni di una vera e propria crisi. Gli elettroni attorno al nucleo non ci dovrebbero stare perché, classicamente, dovrebbero seguire una traiettoria a spirale emettendo radiazioni e precipitare nel nucleo in infinitesime frazioni di secondo. L’atomo visto da Rutherford non ha senso e la formula di Balmer ne ha ancora meno. L’esperimento è sovrano, ma in quel momento dice cose incomprensibili e incompatibili con la fisica classica di Galileo, Newton e Maxwell.
All’acme della crisi, nel 1913 Niels Bohr fa il passo decisivo, che negli anni Venti evolverà in una vera teoria: accettando il verdetto degli esperimenti (l’esistenza delle righe da un lato e la struttura dell’atomo identificata da Rutherford dall’altro) e ispirandosi alle prime idee quantistiche sviluppate col corpo nero e l’effetto fotoelettrico, inventa la prima formulazione della Meccanica Quantistica, postulando che gli elettroni possano sì orbitare attorno al nucleo, ma lo facciano solo ed esclusivamente in orbite ben definite che Bohr collega, con straordinario intuito fisico, alla stessa costante che Planck e Einstein avevano già introdotto per descrivere il corpo nero e l’effetto fotoelettrico. Nella teoria di Bohr gli atomi emettono un fotone quando un elettrone “salta” da un livello più alto a uno più basso e lo assorbono quando compie il percorso inverso. I misteriosissimi numeri di Balmer sono spiegati, sono i numeri che contano i livelli. Se salto dal livello 2 al livello 3, i numeri 2 e 3 della formula sono quelli.
Le regole di quantizzazione di Bohr spiegano perfettamente la formula di Rydberg, collegando la costante stessa alla velocità della luce, alla costante di Planck, alla carica elettrica dell’elettrone e alla massa dell’elettrone. Posso solo immaginare il brivido di gioia che Bohr deve aver provato quando, primo tra gli uomini, ha visto la misteriosissima costante di Rydberg emergere da queste poche e chiare costanti della natura.
La fitta nebbia sul colore degli atomi si dissolse. Ogni atomo ha colori unici perché assorbe luce solo di lunghezza d’onda corrispondente alla differenza d’energia dei livelli diviso la costante di Planck; qualunque colore non corrispondente a uno dei salti è ignorato. Il lavoro di Bohr, seppur in parte euristico e ancor privo di basi solide, è la svolta; la teoria funziona troppo bene, il colore dell’idrogeno è riprodotto troppo precisamente perché sia un caso e la formula che collega la spaziatura tra le righe alle costanti fisiche fondamentali già note un gioiello della fisica. Per quanto empiriche e solo rozzamente giustificate, le regole di quantizzazione di Bohr – poco dopo generalizzate da Sommerfeld (1916) – funzionano troppo bene perché non contengano un frammento di verità. La strada era tracciata.
Pochi anni dopo, le idee feconde e rivoluzionarie di Luis De Broglie e Erwin Schrödinger da un lato, Werner Heisenberg, Pascual Jordan, Max Born e Wolfgang Pauli dall’altro saranno sintetizzate e sistematizzate da Paul Dirac in quel magnifico e sconcertante castello teorico che oggi chiamiamo Meccanica Quantistica, nel quale i concetti di onda e particella – chiari e distinti nel mondo classico – si intrecciano smantellando il determinismo e facendo emergere una nuova idea, quella di “quanto”, un po’ onda, un po’ particella, in fondo nessuna delle due. È una realtà nuova priva d’analogo classico che si rivelerà la chiave per la comprensione del micromondo, dagli atomi ai nuclei atomici fino ai quanti elementari che comunemente chiamiamo particelle. Una realtà intrinsecamente probabilistica in cui la stessa parola realtà necessita d’essere ripensata.
Non v’è qui abbastanza spazio per ripercorre queste tappe; ci basti sottolineare che quasi tutte hanno trovato spunti o conferme nello studio sistematico del colore degli atomi. Fu ancora la minuziosa analisi del colore dell’idrogeno (resa possibile da nuove tecnologie nate dallo sviluppo dei radar) a imporre un ulteriore ripensamento che condurrà alla rigorosa formulazione quantistica della teoria elettromagnetica di Maxwell (l’Elettrodinamica Quantistica o QED), darà un senso compiuto al concetto di fotone inventato da Einstein mezzo secolo prima e, infine, sfocerà nel moderno Modello Standard.
 Marco Pallavicini è professore di Fisica generale e Fisica delle astroparticelle presso l’Università degli Studi di Genova. Si occupa di ricerca, didattica e divulgazione scientifica, è vicepresidente dell’INFN. Lavorando in numerosi esperimenti scientifici e in diversi laboratori di ricerca internazionali, si è occupato principalmente di fisica delle particelle, delle astroparticelle, della materia oscura e del neutrino.
Marco Pallavicini è professore di Fisica generale e Fisica delle astroparticelle presso l’Università degli Studi di Genova. Si occupa di ricerca, didattica e divulgazione scientifica, è vicepresidente dell’INFN. Lavorando in numerosi esperimenti scientifici e in diversi laboratori di ricerca internazionali, si è occupato principalmente di fisica delle particelle, delle astroparticelle, della materia oscura e del neutrino.
Saggio redatto per il catalogo della mostra “Quanto. La rivoluzione in un salto”.






